质量管理体系的终极目标,就是“离了谁都能活”

一、QA不该相信秘方
小时候的教育,我们读了很多故事。类似于有一个秘方,只有一个88岁的老头知道,他8岁就跟着爷爷学这个,再也无人能做。
QA应该相信吗?
一份好的SOP就是流程,一份好的SMP就是一个标准。也许在传男不传女的年代,老爷子的这种本事被认为是绝学,可我们是制药企业,是现代化工厂,是要有技术标准和流程的,QA本就不该相信秘方。
SOP需要培训,培训需要分级,只能说常见的培训级别是三级,但更细致的分类并没说过不被允许。高管和受训和基层员工肯定不同,技术人员和管理人员的受训内容也该不同。
QA是一个要把技术可以沉淀在平台上的工作,受训人员可以按章操作是SOP的基本作用。如果一个操作步骤必须是一个老师傅亲自凭感觉操作,所谓的老师傅老经验,那么也是一个失败的SOP。你可以说有些技术必须老师傅在,那么就是基础研究,研发部门应该把原因找出来的。现有技术限制下找不到的原因,其实在生产型企业并不会太多,至少在研发阶段就应该被发现和标记的,风险提示清晰,有预警和处理方案。
二、流程是为了更低的管理成本
重复流程管理,甚至于有的企业有两套SOP,一套是专门应付药监局的,操作人员们被训练成两幅面孔,现场核查时的操作和平时操作不一样。QA们觉得很累,操作人员觉得很累,各个部门都觉得有沉重的心理负担。这样的流程,会比一套真实的流程更简单,成本更低吗?
有人说,我们明明用A方案更方便,药监局就教条的一定要B,我们的流程怎么可能顺利?
看下一条。
三、企业利益是最高利益
前提是企业利益是合法,合乎道德,合乎科学,合乎基本法规原则的。
举个例子来说:生物制品分段生产。
几乎所有的海归都会问我一个问题:在美国,单抗的生产可以原液和制剂分开,为什么中国不可以?为什么广东发过一张疫苗境内灌装证,原液在境外生产进口的,而我们不可以把原液在境外生产,境内灌装?
我会说:我们下象棋,美国打德州扑克。境内监管法则没改的时候,我不挑战基本法规原则。我认为这是地域要求差异。做任何决策时,当地法规的基本原则应该是首要考虑的因素,我们无法把特例作为范例。而且,那张灌装证发生了巨大的风险,新建原液生产线时收回了,该公司老大引咎辞职。
当你能够降低风险,降低产品上市后的风险,降低企业的风险,这里的风险不仅仅包括产品质量还有供应商稳定性,运营稳定性等等,企业利益就是最高利益。
四、最高的企业利益和质量利益从不矛盾
多数QA和我说的几乎都是质量问题。没错,QA就是质量保证,好像定的SOP什么的,都只和产品质量有关系,可事实上,好的QA定的流程关乎的不仅仅是产品生产质量。
供应商审计文件是一个典型的例子。
那个年代,我国还没说什么原辅包关联审评审批,但我记得师傅们是很重视这条的,公司采购的SOP绝对不应该把流程和标准只以价格为准。从制定供应商审计文件,各类表格、信访要求,甚至是采购合同,质量协议开始,师傅们就要求了一系列的文件、数据要求。这不是药监局规定的,这是师傅们给自己的企业留的一条保障,保障供应,保障质量,保障合作研究,核心利益。
根据药物经济学,越有竞争力的产品,反而越注重质量,当万众瞩目的时候,它的风险和被揭发的可能性越大,它严密的质量保障体系不是为了应付监管的,而是应付商业间谍卧底谋害的。
质量利益从来就不是一个产品的质量,而是整个体系的质量。
一个好的体系下,产品是个体情况。也许普药的时候,它的价值体系不出来,但终究有产品会体现出一个质量保证体系价值的。
五、历史问题本来就该逐步解决,有哪个QA说没有解决过历史问题?
比如说老工艺,设备更新,原先流程图,各种备案更新……从来就没有完美的文件,你也不可能接手一个完美的体系。时代在进步。
六、改三处重抄是最无能的QA
老师傅提醒了一句,还记得某某某吗?
那是我们招聘过的一个QA,女。她最大的本事就维持记录的干净,她说自己有洁癖,她做出来的批记录是最漂亮的,总被药监局现场核查的时候表扬的。
而师傅们对她的评价就是无能。
一页纸改了三处要重抄,这是她在的时候定的规矩。执行了一个月,终止。
这么做有何意义?除了形式主义,溜须拍马的功能以外,只能说对于平台、流程、纠偏改善没有任何的好处。
如果你真认为是表单设计有问题,导致操作人员经常容易在这页填写的时候发生错误,为什么不升级空白表单呢?
重抄,让操作人员有了原始记录可以更改的机会和理念,这是一个QA在建立质量文化和质量体系的时候最不应该做的事情,这件事对于流程和体系没好处,但破坏了原始记录不得更改的基本理念。
这样的QA建立的体系被整个公司看不起,被所有人认为QA就是改错别字的、批记录不写没事儿,以后可以补,可以抄……这是活该。
七、最了解企业是QA
你定的不是一个产品的质量标准,也不是一个岗位的SOP,更不是每天去看看操作人员有没有按规定写记录,修改有没有单线划掉签字……而是了解这个企业的流程、文化,不是为了八卦,而是为了让体系改进、顺畅,让每个人顺手。
所以我们理解不了伸手党。每个公司的产品、行政体系流程都是不一样的,设备、厂房、原辅料都是不一样的,你怎么能上网下载一个SOP拿来改改就用呢?除了一些设备使用、保养的SOP因为是供应商提供的,可能雷同之外,其他的,真的能拿其他公司的来套用吗?
偏差、风险评估、验证方案……这个……你真觉得可以通用吗?
八、QA的核心价值就是让企业脱离个人
依靠个人的体系是一个糟糕的体系。
如果你说人才很重要,那是顶级人才。
来一批实习生,按流程培训,考核,上岗,能接受干活,产品体系稳定,差异可接受……那是平台,一个建立之后有意义的体系。
跳槽就跳槽吧,好的体系就是黄埔军校,任何一个行业都要接受这个事实。事实就是,好的平台并不强求员工终身忠诚,它只追求你在职期间的恪尽职守。而你,会留下来的。
常听到的几句话,各位质量人自己体会:
九、符合企业利益的流程肯定符合药监需求
是谁说企业利益和药监需求是矛盾的?
难道你们企业的利益就是违反监管吗?
参见第三、四条。
你要说地方监管差异巨大,省局不懂。那么为啥把省局叫亲妈呢?当地监管都不帮忙,那说明啥?说明你们公司带来的职业风险远大于你们能带给当地的经济利益。现在总局收权了,你们应该欢呼雀跃才对。不管承不承认吧,如果说监管要求是这个行业的企业都需要遵守的基本要求,那么扔在市场竞争环境里的企业,就应该是高于监管要求的。这样的情况的,怎么会出现符合企业要求利益的管理是必须违反监管要求的呢?
十、有偏差是正常的
很多人认为偏差不应该给药监局看的,偏差多说明企业不好。这个理论上是某个地方药监告诉企业的吗?
偏差分类,风险要评估。一个活着的企业,有各种偏差有什么好意外的?运营过程中的各种偏差出现,记录,纠偏吧,有什么羞于见人的呢?
不是偏差见不得人,而是多数的QA没能力纠偏,所以索性就当偏差看不见,这才是悲剧。
十一、隐瞒是最高级别风险
有人问,报喜不报忧是不是QA喜欢的?
任何一个体系都不应该放过这些报喜不报忧的员工,因为这些员工是最大的安全隐患。
十二、可以有不体现,但不可以无法溯源
很多人一开会就说不体现,也说这是企业没有道德的表现。
现在看来,这是两回事。不体现不代表不存在。
很多表单、验证数据、研究数据是涉及企业机密的,可能是基本监管要求之外的,从来都没有说过企业所有的数据均应该主动上交给药监局。药监有技术准入标准,企业可能做的要多得多。
不体现的东西不代表是造假,从来就不是说不体现的东西就是见不得人的东西,而是没必要什么都说,但如果你觉得支持性数据不够还需要问我要,我有就是了。
做过的事情,有记录,就不会白做,但没有记录是可怕的。
十三、接受不完美,然后去完善
小妖是处女座的,进质量保证部的第一天,师傅说:根据十二星座的算法,你的八字和本部门很合。可是QA部门不仅仅是力求完美,更重要的是接受不完美。
没有人是可以做到完美的,往往是表单发下去了,才发现有几行的行距有点不太对;往往是办公软件使用和文件倒换的时候就会出现意料之外的问题;各种空白样张记录就需要不停地升级……尽可能要求完美,更要接受不完美,然后去努力纠偏追求完美。
有人设计的表单就是很好用,有人写的SOP就是很好操作,有时候我们认为是运气好,但他实际就是做事仔细。你可能有一堆觉得你龟毛的同事,但一旦有问题,他们第一个能想起你,这就够了。
十四、大局观
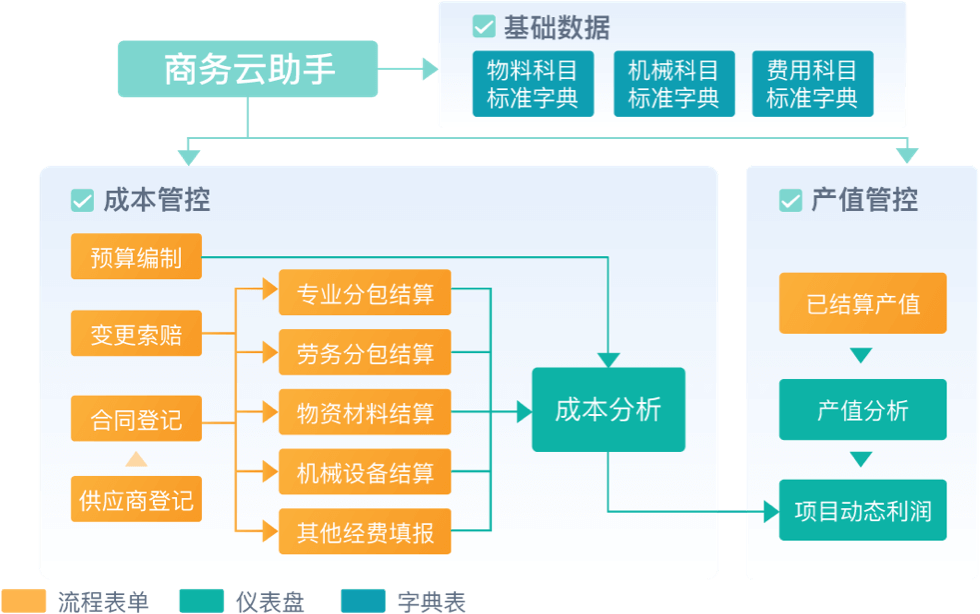
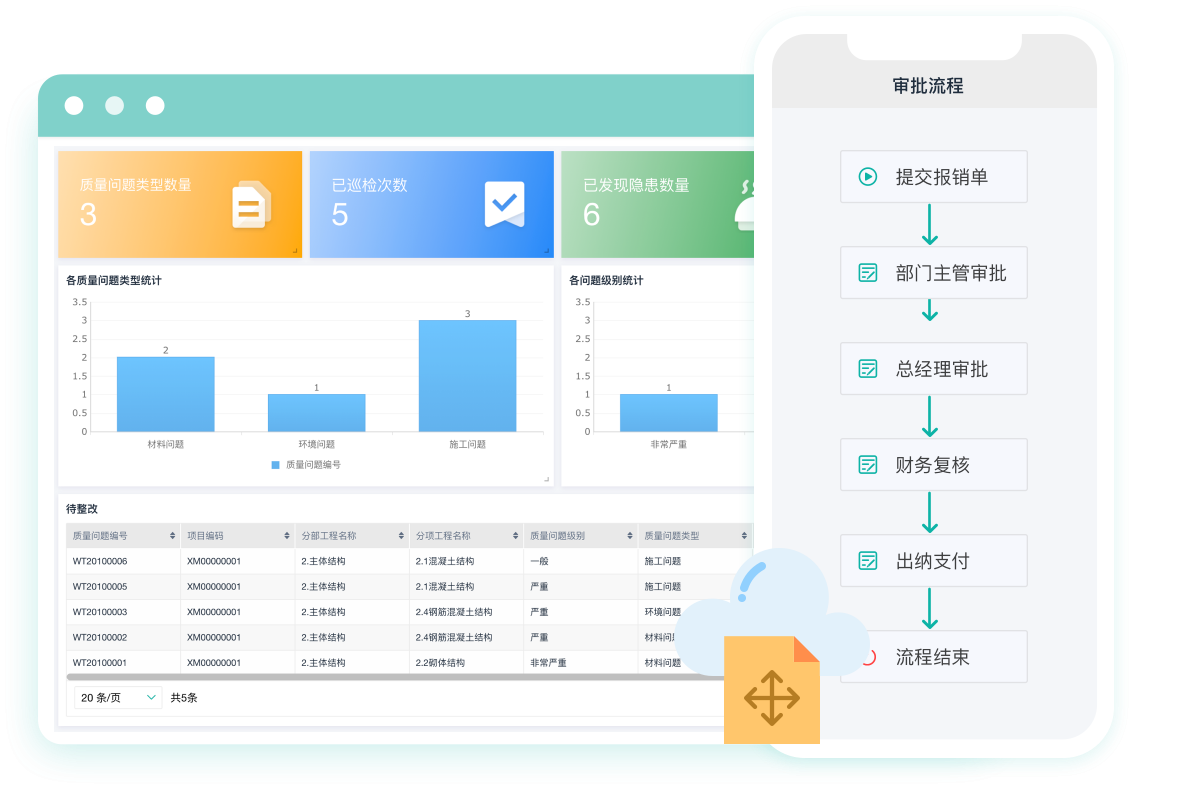
推荐一款工程项目管理软件,简道云,一款零代码轻量级的应用搭建平台。管理员无需代码,即可构建出符合需求的业务管理系统(如生产管理、进销存等)。员工电脑、手机均可使用,随时随地都能处理业务。用户能够通过拖拉拽自定义设计表单、通过简单连线设计流程、通过组件丰富的仪表盘对数据进行展示,还可以通过高级功能打破数据孤岛、挖掘数据的价值。这些功能能够满足用户个性化的应用搭建需求。