生产医疗器械软件 条件
-
已被采纳为最佳回答
在生产医疗器械软件之前,必须满足一系列严格的条件。包括合规性、质量管理体系、风险管理、临床验证、数据安全和隐私保护、用户培训和支持、持续监控和改进等。其中,合规性是最为关键的一环,医疗器械软件需要遵循相关的法律法规及行业标准,如FDA、ISO 13485等,以确保其安全性和有效性。合规过程通常涉及到对软件开发的每个阶段进行严格的文档记录和审核,从需求分析到设计、开发、测试,再到最终的市场发布。这样可以确保软件在整个生命周期中都符合相关的法律法规,降低潜在的法律风险和市场责任。
一、合规性
医疗器械软件的开发和生产必须遵循严格的合规要求。根据不同国家和地区的法律法规,软件可能需要获得不同的认证。例如,在美国,医疗器械软件需要遵循FDA的规定,尤其是21 CFR Part 820(质量体系规范)。这要求生产商建立和维护一个全面的质量管理体系,以确保产品的安全性和有效性。在欧洲,医疗器械软件则需要符合医疗器械指令(MDR),并通过CE标志认证。合规过程涉及到对开发流程、产品设计、测试方法及文档管理等方面的全面审查和记录。确保合规不仅能降低法律风险,还能增强客户对产品的信任,提升市场竞争力。
二、质量管理体系
建立完善的质量管理体系是医疗器械软件生产的另一重要条件。这一体系包括了对整个开发过程的规范化管理,确保每一个环节都符合相关的质量标准。ISO 13485是国际上广泛认可的医疗器械质量管理标准,涵盖了从产品设计、开发到生产、安装和服务的各个阶段。一个有效的质量管理体系能够帮助企业识别和控制产品风险,确保产品在设计和制造过程中达到预期的质量要求。此外,企业还需要定期进行内审和外部审核,以持续改进质量管理体系的有效性,确保其始终符合最新的行业标准和法规要求。
三、风险管理
在医疗器械软件的生产过程中,风险管理是一个不可忽视的环节。医疗器械软件的风险管理通常遵循ISO 14971标准,该标准提供了一种系统的方法来识别和评估与医疗器械相关的风险。企业需在产品开发的早期阶段就进行风险识别,评估潜在的危害及其后果,并采取适当的控制措施来降低风险。风险管理不仅仅是符合法规的要求,它更是保障患者安全和产品有效性的关键环节。通过有效的风险管理,企业能够更好地应对产品在使用过程中可能出现的各种问题,降低因软件缺陷导致的医疗事故风险。
四、临床验证
医疗器械软件在上市前需要进行临床验证,以证明其安全性和有效性。临床验证通常需要通过临床试验收集相关数据,评估软件在实际使用中的表现。临床试验的设计和实施需要遵循严格的伦理标准,确保参与者的权益和安全。在试验过程中,企业需收集和分析数据,以证实软件在预期用途上的有效性。临床验证不仅是法律要求,也是提高产品市场竞争力的重要手段。通过充分的临床验证,企业可以获得用户的信任,增强品牌形象。
五、数据安全和隐私保护
在数字化时代,医疗器械软件的生产还必须重视数据安全和隐私保护。随着医疗信息化的加速发展,用户数据的安全性和隐私性成为重中之重。企业需要遵循相关法律法规,如GDPR等,确保用户数据在收集、存储和传输过程中的安全。此外,企业还需要建立相应的数据保护措施,包括数据加密、访问控制和定期安全审计等,防止数据泄露和未授权访问。一个重视数据安全的企业不仅能减少潜在的法律风险,还能赢得用户的信任,从而提升市场竞争力。
六、用户培训和支持
医疗器械软件的成功应用离不开用户的有效培训和支持。企业需要为用户提供详尽的培训,确保他们了解软件的功能和操作方法。培训可以通过多种形式进行,包括面对面的培训、在线课程、用户手册等。除了培训外,企业还需提供持续的技术支持,帮助用户解决在使用过程中遇到的问题。良好的用户培训和支持能够提高用户的满意度,减少软件使用中的错误,从而提升软件的整体使用效果和安全性。
七、持续监控和改进
医疗器械软件在上市后仍需进行持续监控和改进。企业需要收集用户反馈和使用数据,及时识别和解决潜在问题。通过持续的性能监控,企业可以发现软件在实际使用中的不足之处,并进行必要的改进。同时,企业还需定期进行软件的更新和维护,确保其始终符合最新的行业标准和法规要求。持续的改进不仅能够提高软件的性能和用户体验,还能增强用户的信任和满意度,促进企业的长期发展。
通过满足以上条件,企业可以有效地生产出符合市场需求、安全可靠的医疗器械软件,促进医疗行业的健康发展。
1年前 -
生产医疗器械软件需要满足一系列条件,包括技术、法律法规、质量管理等方面的要求。下面将从不同角度详细介绍这些条件。
技术条件
1. 软件开发团队
- 组建专业的软件开发团队,团队成员包括软件工程师、测试工程师、项目经理等。
- 团队成员需具备相关的医疗器械软件开发经验和技能,了解相关的法规和标准。
2. 软件开发工具
- 确定合适的软件开发工具和技术平台,如开发语言、集成开发环境等。
- 确保软件开发工具符合相关的标准和要求,能够支持医疗器械软件的开发和测试。
3. 质量控制
- 建立完善的软件质量控制体系,包括代码审查、测试流程、Bug修复等。
- 确保软件开发过程中的质量控制符合相关的标准和要求,保证软件的可靠性和稳定性。
法律法规条件
1. 医疗器械监管法规
- 了解并遵守国家和地区相关的医疗器械监管法规,确保软件开发符合法律要求。
- 申请相关的医疗器械软件生产许可证和备案手续,确保合法生产和销售。
2. 隐私保护
- 遵守用户隐私保护的相关法规和政策,确保医疗信息的安全和保密性。
- 加强数据加密和访问控制,保护用户的个人信息不被泄露。
质量管理条件
1. 质量管理体系
- 建立和实施符合ISO 13485等相关标准的质量管理体系,确保医疗器械软件的质量和安全性。
- 定期进行内部和外部的质量审核,及时纠正和预防质量问题。
2. 风险管理
- 开展软件开发过程中的风险评估和管理,识别和控制潜在的风险。
- 确保软件设计和功能满足医疗器械使用的安全性和有效性要求,减少潜在风险。
过程控制条件
1. 软件生命周期管理
- 确立完整的软件生命周期管理流程,包括需求分析、设计、开发、测试、部署和维护等阶段。
- 确保软件开发过程中的每个阶段都有明确的规范和控制措施,以确保软件质量和安全性。
2. 变更管理
- 建立严格的软件变更管理流程,对软件的任何变更都需要经过审批和记录。
- 确保变更管理流程的透明和可追溯性,避免因变更引起的质量问题。
综上所述,生产医疗器械软件需要满足的条件涵盖了技术、法律法规、质量管理和过程控制等多个方面。只有全面考虑这些条件,并严格执行相关要求,才能生产出符合医疗器械软件质量和安全性要求的产品。
1年前 -
生产医疗器械软件是一项涉及医疗行业和软件开发领域的复杂工作。在开展这项工作之前,有一些关键条件需要满足,以确保软件的质量、安全性和合规性。以下是生产医疗器械软件所需的条件:
-
了解医疗器械行业:首先,需要对医疗器械行业有一定的了解,包括相关法规、标准、流程和术语。理解医疗器械的分类、注册、审批流程等是至关重要的。
-
医疗器械软件开发经验:具备软件开发经验和技能是必不可少的。熟悉软件开发的流程、方法和工具,包括需求分析、设计、编码、测试和维护。
-
遵守法规和标准:生产医疗器械软件需要遵守一系列法规和标准,如FDA的21 CFR Part 820、ISO 13485等。了解并遵守这些法规是确保软件符合法律法规要求的关键。
-
质量管理体系:建立健全的质量管理体系是保证软件质量和安全性的关键。要确保软件开发过程中的每个环节都能够被有效控制和管理。
-
安全性保障:医疗器械软件的安全性至关重要。需要进行安全风险评估、漏洞管理、数据加密等措施,确保软件在使用过程中不会对患者造成伤害。
-
与医疗机构合作:与医疗机构合作是开发医疗器械软件的重要途径。了解医疗机构的需求和反馈,不断改进软件功能和性能。
-
团队合作能力:医疗器械软件开发是一个复杂的跨学科工作,需要与医生、工程师、设计师等多个团队密切合作。良好的团队合作能力是成功的关键。
-
持续学习和创新:医疗器械行业和软件技术都在不断发展,需要保持持续学习和创新的态度,跟上行业的最新动态和技术趋势。
总之,生产医疗器械软件需要具备丰富的行业知识、技术能力和法规意识,同时要注重质量管理、安全性和与医疗机构的合作。只有全面考虑这些条件,才能生产出符合标准和患者需求的高质量医疗器械软件。
1年前 -
-
生产医疗器械软件是一项非常重要的任务,需要满足一系列严格的条件,以确保软件的质量、安全性和合规性。以下是生产医疗器械软件所需满足的一些关键条件:
-
合规性要求:生产医疗器械软件必须符合相关的法规和标准,如美国FDA的21 CFR Part 820、欧盟的医疗器械指令(MDD)或新的医疗器械规例(MDR)等。软件开发公司需要了解并遵守这些法规,确保软件符合法律要求。
-
风险管理:在开发医疗器械软件时,风险管理是至关重要的。开发团队需要进行全面的风险评估,识别潜在的风险并采取措施来降低这些风险。风险管理文件需要与软件开发过程紧密结合,确保软件在使用过程中不会对患者造成危害。
-
质量管理体系:建立和执行有效的质量管理体系是保证医疗器械软件质量的关键。软件开发公司需要遵循ISO 13485等质量管理体系标准,确保软件开发过程中的质量控制和质量保证。
-
验证和验证:医疗器械软件需要经过严格的验证和验证过程,以确保软件的功能和性能符合规范要求。验证是确认软件是否满足规格的过程,而验证则是确认软件是否符合最终用户的需求。
-
文档管理:在开发医疗器械软件时,需要建立完善的文档管理体系,记录软件开发过程中的所有信息和决策。这些文档对于后期的审计、维护和更新非常重要,确保软件的可追溯性和持续改进。
总的来说,生产医疗器械软件需要遵循严格的法规要求、进行全面的风险管理、建立有效的质量管理体系、进行严格的验证和验证,以及建立完善的文档管理体系。只有在满足这些条件的前提下,才能生产出安全、可靠的医疗器械软件,为患者和医疗机构提供优质的服务。
1年前 -



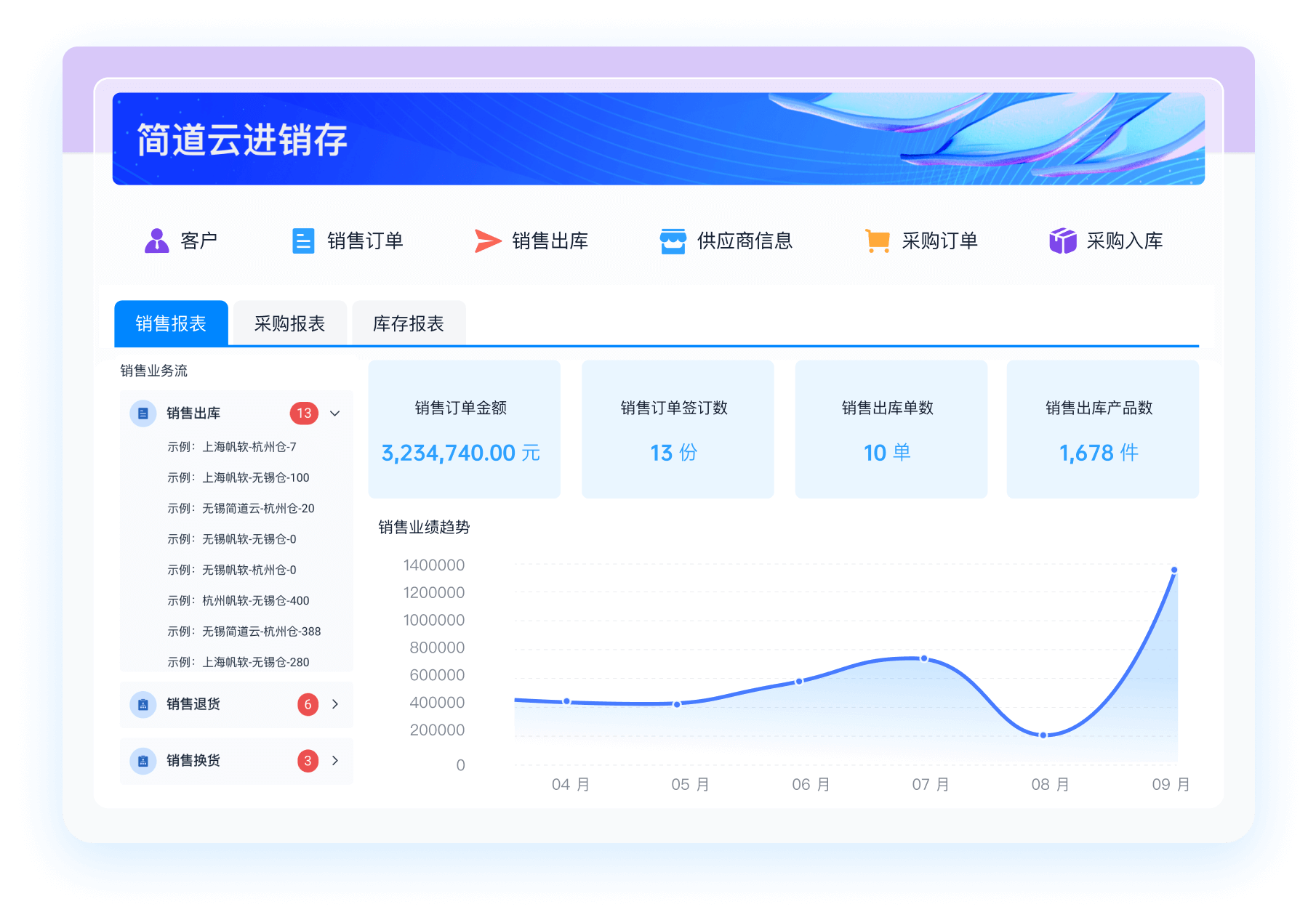
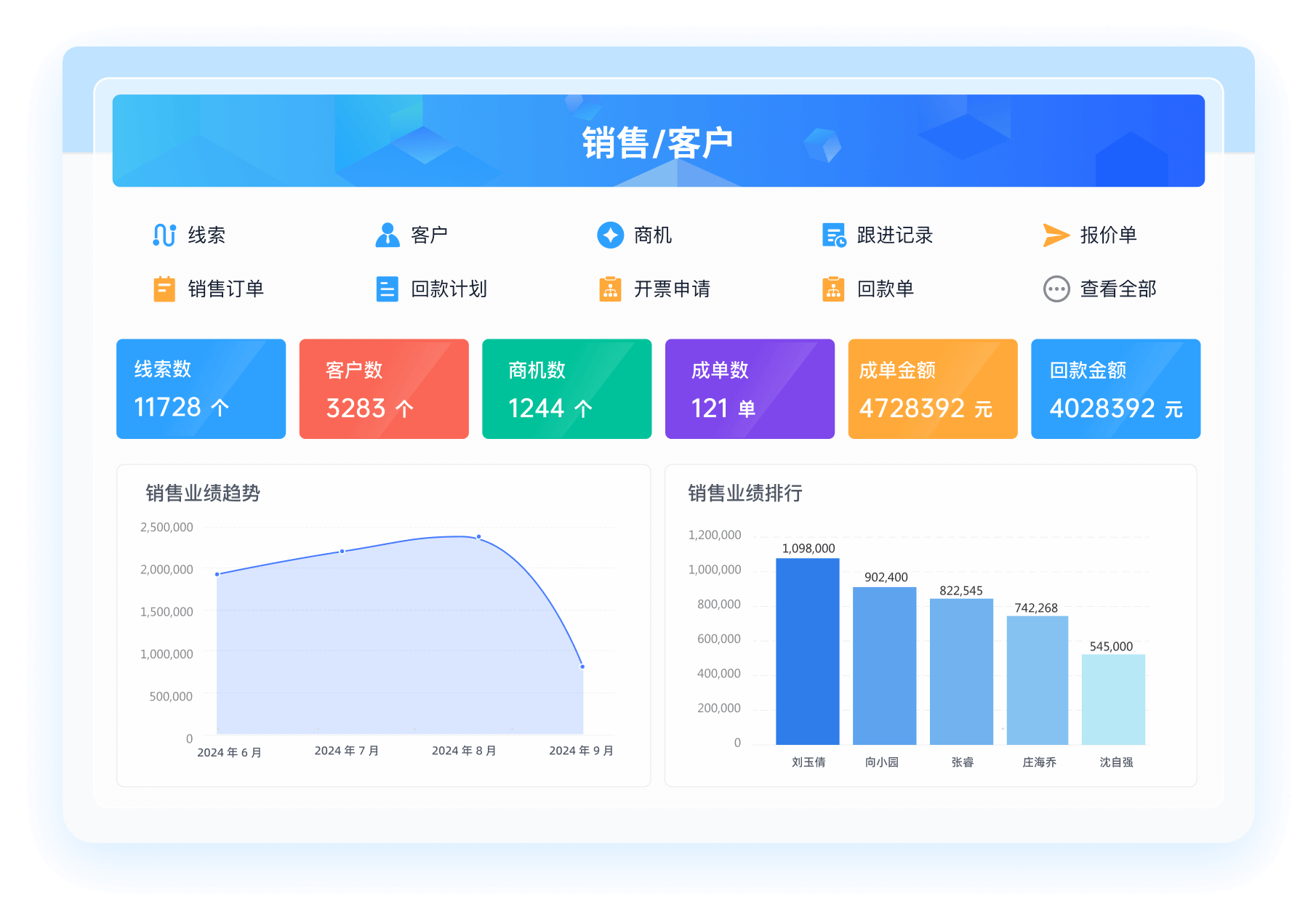
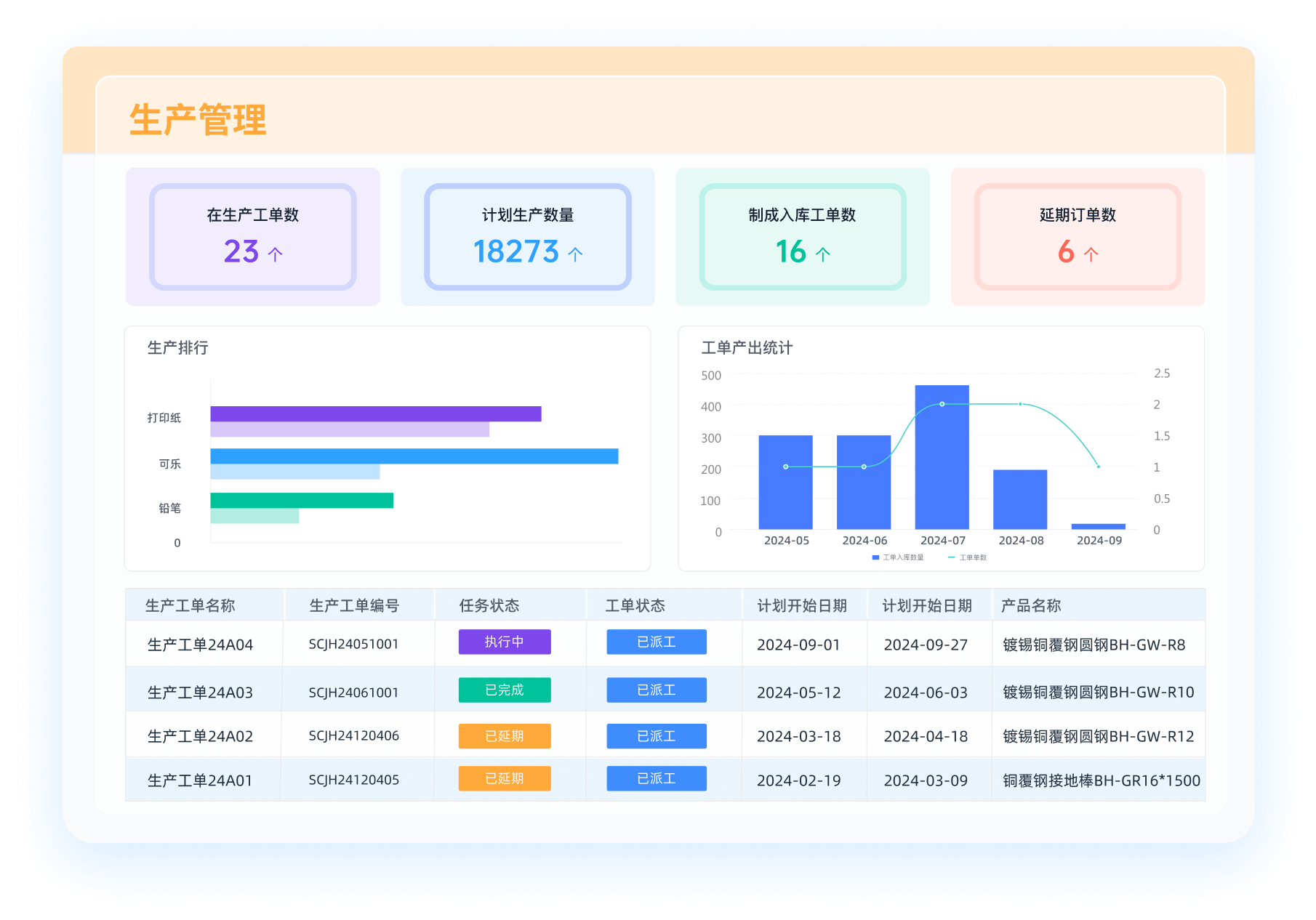
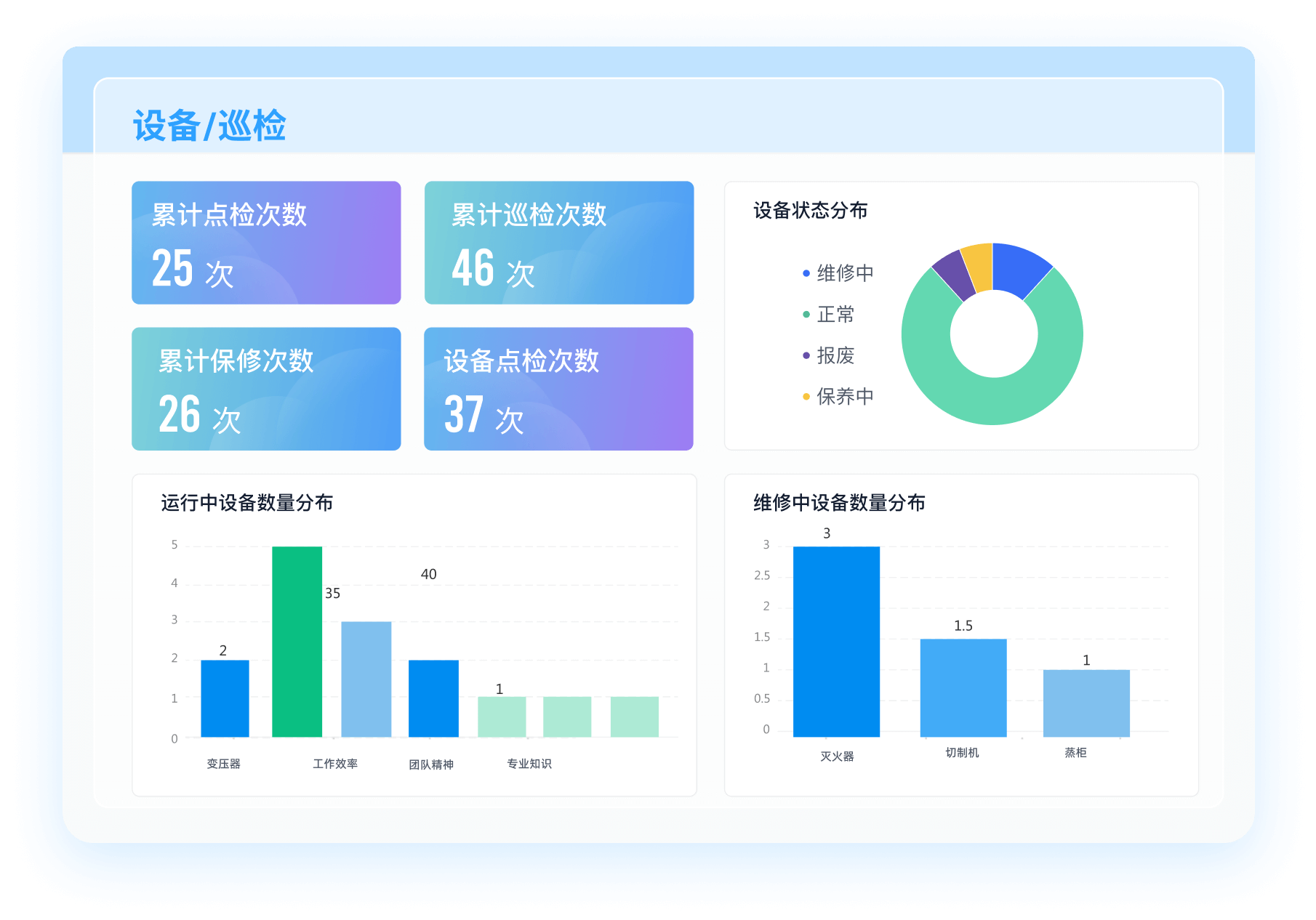



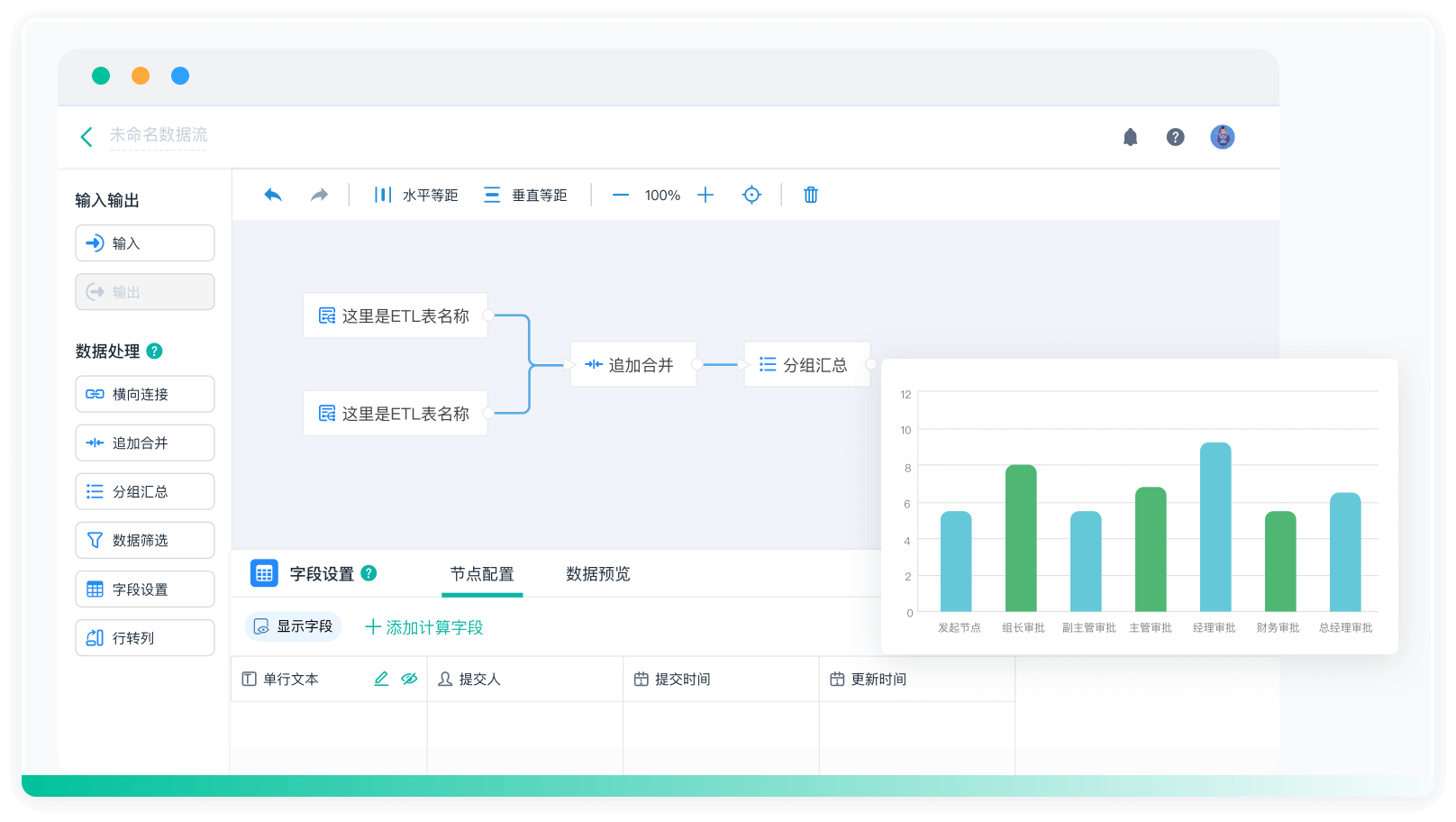
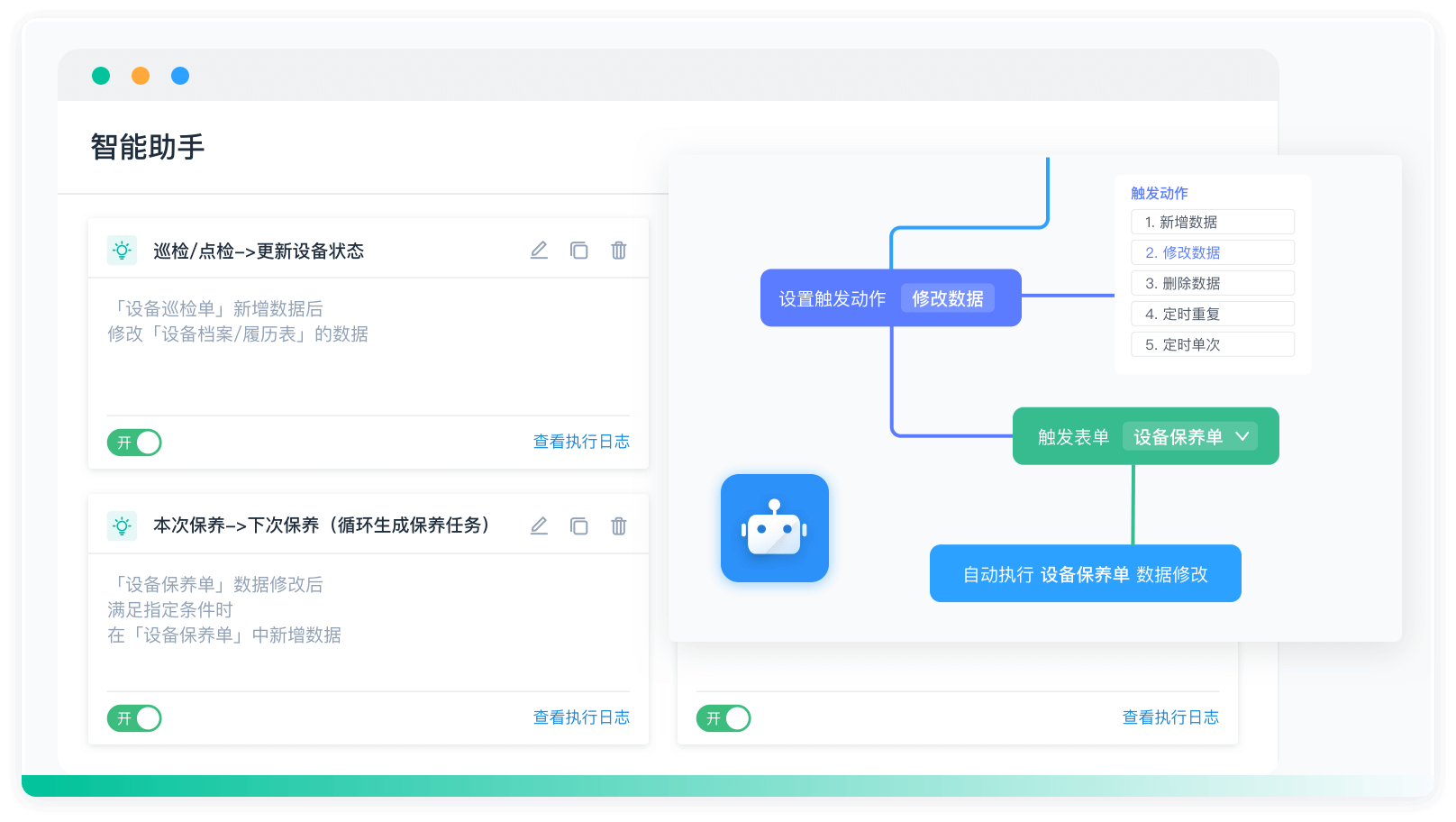
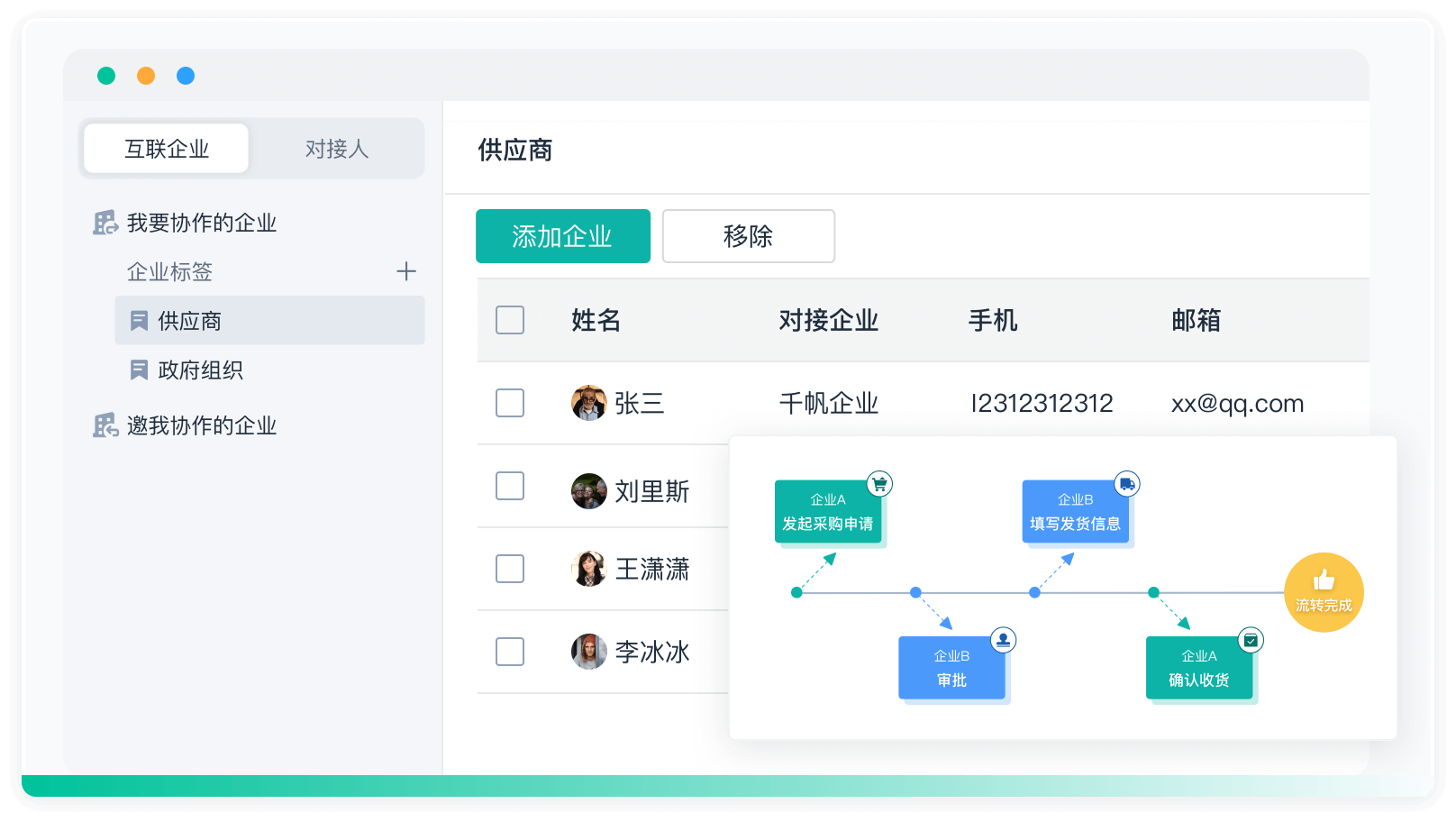
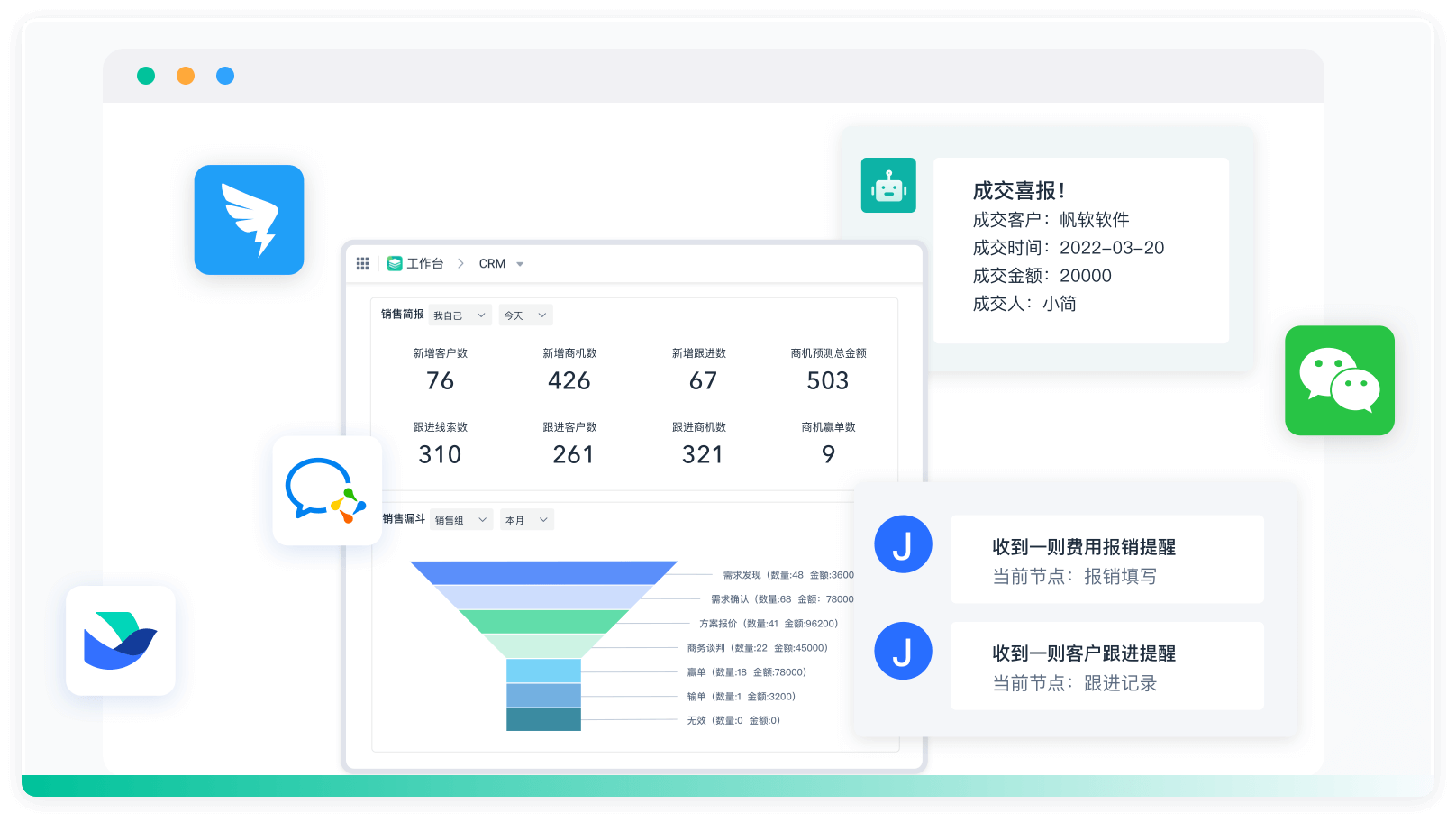

















































 《零代码开发知识图谱》
《零代码开发知识图谱》
 《零代码
新动能》案例集
《零代码
新动能》案例集
 《企业零代码系统搭建指南》
《企业零代码系统搭建指南》










领先企业,真实声音
简道云让业务用户感受数字化的效果,加速数字化落地;零代码快速开发迭代提供了很低的试错成本,孵化了一批新工具新方法。
郑炯蒙牛乳业信息技术高级总监
简道云把各模块数据整合到一起,工作效率得到质的提升。现在赛艇协会遇到新的业务需求时,会直接用简道云开发demo,基本一天完成。
谭威正中国赛艇协会数据总监
业务与技术交织,让思维落地实现。四年简道云使用经历,功能越来越多也反推业务流程转变,是促使我们成长的过程。实现了真正降本增效。
袁超OPPO(苏皖)信息化部门负责人
零代码的无门槛开发方式盘活了全公司信息化推进的热情和效率,简道云打破了原先集团的数据孤岛困局,未来将继续向数据要生产力。
伍学纲东方日升新能源股份有限公司副总裁
通过简道云零代码技术的运用实践,提高了企业转型速度、减少对高技术专业人员的依赖。在应用推广上,具备员工上手快的竞争优势。
董兴潮绿城建筑科技集团信息化专业经理
简道云是目前最贴合我们实际业务的信息化产品。通过灵活的自定义平台,实现了信息互通、闭环管理,企业管理效率真正得到了提升。
王磊克吕士科学仪器(上海)有限公司总经理